williamhill新闻网12月18日电 近期,williamhill官网williamhill中国官方网站刘翔宇教授课题组与中南大学湘雅医院产科张卫社教授课题组合作研究,报道了前列腺素F2α受体(FP受体)与低选择性配体卡前列素和高选择性配体拉坦前列素(游离酸形式)结合G蛋白复合物的高分辨率冷冻电镜结构,揭示了前列腺素和临床药物对FP受体的选择性机制,以及与前列腺素受体相关的G蛋白偏向性的分子机制,为靶向FP受体的药物研发提供了结构基础。
前列腺素是一类在动物体内产生的生理活性脂质,它们来源于花生四烯酸,自1930年,第一个前列腺素被瑞典生理学家乌尔夫·冯·奥伊勒发现后,有数十种前列腺素被分离鉴定出来。它们都具有二十个碳原子,包括一个五元脂肪环,并根据五元脂肪环上取代基的不同将前列腺素分为D、E、F等不同类型。不同种类的前列腺素参与多种生理过程,如PGE2参与炎症、PGD2与免疫反应相关、PGF2α调节子宫平滑肌,而PGI2对循环系统有正调节作用。前列腺素的作用是多样的,取决于其与特定受体的结合及所在的组织环境。
伴随着越来越多的前列腺素被发现,另外一个谜题却浮出水面:生物体如何识别不同种类前列腺素间的微小差别?对相关选择性机制理解有助于指导靶向前列腺素受体的药物设计。
以该研究关注的FP受体为例,FP受体在女性生殖系统尤其是子宫平滑肌中高表达,被配体激活后可引起强烈的子宫收缩。FP受体激动剂卡前列素是内源性配体PGF2α的衍生物,被广泛用于产后出血的治疗,尤其是难治性产后出血。但是,卡前列素因可以脱靶激活EP3受体,导致发热、高血压等副作用。FP受体的高选择性激动剂拉坦前列素,同样也是PGF2α的类似物,目前主要用于治疗青光眼,由于其溶解性及较高的清除率,限制了其在产后出血方面的应用(图1a)。
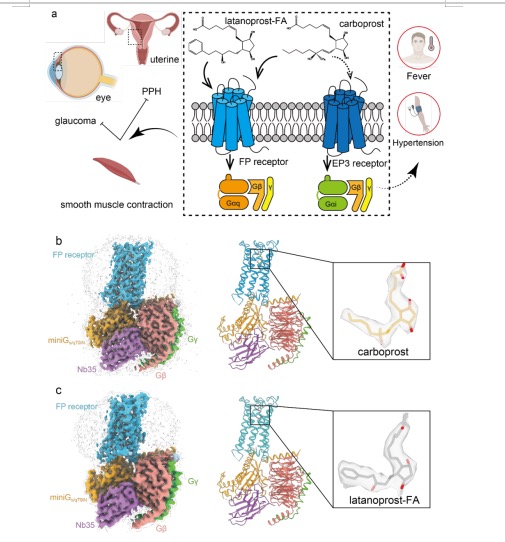
图1. FP受体的功能以及卡前列素和拉坦前列素结合FP-G蛋白复合物整体结构图:a, FP受体的功能以及FP受体高选择性激动剂拉坦前列素和低选择性激动剂卡前列素的病理生理作用; b-c, 卡前列素(b)和拉坦前列素(c)结合FP-miniGs/q70iN复合物的冷冻电镜整体结构图
该研究利用冷冻电镜技术解析了两种临床药物卡前列素和拉坦前列素结合人类FP受体-G蛋白复合物结构,分辨率分别为2.7Å和3.2Å(图1b, c)。在FP受体中卡前列素和拉坦前列素被包埋在一个疏水的口袋中,只留有一个亲水的基团和五元脂肪环的极性取代基与FP受体形成极性的相互作用。清晰的原子分辨率结构给选择性谜题的解决带来了崭新的视角,揭示了卡前列素脱靶效应的成因:与其他前列腺素受体相比,FP受体和EP3受体的配体结合口袋极为相似,这个口袋紧紧包裹了卡前列腺素,这种相似性大大降低了配体识别的能力,造成了卡前列腺素的脱靶和副作用。然而,这依然无法解释前列腺素在受体间的选择性问题,更多的结构细节依然需要被研究者挖掘。
研究组首先将目光投向了前列腺素的五元环结构上,这是前列腺素分类的依据,同样也是内源性前列腺素最多变的结构。通过对相关区域的仔细探查,研究者发现,前列腺素受体与配体产生极性相互作用的区域也集中在五元环的区域,这同样也是前列腺素受体保守性最低最多变的区域。前列腺素选择性机制的假设应运而生:前列腺素的五元环结构与受体形成了氢键网络,通过极性残基的变化识别五元环上不同的取代基。这个假设同样被活性实验验证,通过对位突变的实验,FP受体和EP3受体对配体的选择性被轻易改变。
但是,新发现的选择性机制依然无法解释两种临床药物之间的选择性差别:拉坦前列腺素和卡前列素最主要的差别在远端,拉坦前列腺素以苯环作为末端,而卡前列腺素则更像内源性配体,以甲基作为末端。末端区域远离先前发现的五元环极性口袋,这提示了还有新的选择性机制未被发现。
通过对末端结合口袋的探查,研究组发现,在FP受体中,拉坦前列腺素的末端苯环与受体的三个苯丙氨酸形成了强烈的“π-π堆积”,但是在EP3受体中,这种“π-π堆积”却被一个脂肪侧链打破。π-π相互作用被打破会是配体选择性的来源吗?研究组进一步进行了对位突变的实验。实验结果表明打破或补偿这一对π-π相互作用彻底逆转了拉坦前列腺素的选择性,这说明苯环与苯丙胺酸之间的π-π相互作用是拉坦前列腺选择性的原因。至此,困扰人们多年的前列腺素选择性机制也初步展示出它的庐山真面目。
另外,不同的前列腺素受体亚型偶联不同的G蛋白。研究组将FP-Gq蛋白复合物结构与已解析的EP2-Gs复合物以及EP3-Gi复合物结构进行比较,也初步揭示了前列腺素受体对不同G蛋白选择性的分子机制。
总体而言,该研究既揭示了前列腺素及其类似物对于FP受体的选择性分子机制,也揭示了前列腺素受体对G蛋白的选择性分子机制。这将为后续以FP受体为靶点的药物开发提供重要的研究基础,尤其是开发副作用更小的治疗产后出血的药物。
相关研究成果于12月8日以“人源前列腺素F2α(PGF2α)受体对配体及G蛋白选择性的分子机制”(Structures of human prostaglandin F2α receptor reveal the mechanism of ligand and G protein selectivity)为题发表在《自然·通讯》(Nature Communications)期刊上。
williamhill官网williamhill中国官方网站教授刘翔宇与中南大学湘雅医院教授张卫社为论文的共同通讯作者。中南大学湘雅医院博士生吕秀清、聂佳,williamhill官网williamhill中国官方网站博士生高凯旋为论文的共同第一作者。研究中的冷冻电镜数据在williamhill官网蛋白质研究中心-冷冻电镜平台收集。该研究得到国家自然科学基金、北京生物结构前沿研究中心和生命科学联合中心的资助。
论文链接:https://www.nature.com/articles/s41467-023-43922-8
供稿:williamhill中国官方网站
题图设计:赵存存
编辑:李华山
审核:周襄楠
