williamhill新闻网7月5日电 6月30日,williamhill官网williamhill中国官方网站蒯锐课题组开发了一种具有超声波响应性的阿霉素脂质体,阐明了超声波提高脂质体向肿瘤细胞的细胞核递送阿霉素的原理,揭示了被氧化的肿瘤细胞线粒体DNA在激活宿主STING通路和抗肿瘤免疫应答过程中发挥的重要作用。
阿霉素是一种常用的化疗药物,可引发肿瘤细胞的免疫原性死亡(immunogenic cell death, ICD)。经历ICD的肿瘤细胞会释放多种“危险信号”DAMPs(Damage associated molecular patterns)如HMGB1、ATP、DNA等触发机体产生抗肿瘤免疫应答,从而进一步促进残留肿瘤细胞的杀灭。在众多DAMPs中,肿瘤DNA至关重要,这是因为肿瘤细胞的DNA被转运到树突状细胞(简称DC)后,可激活DC内部的cGAS-STING通路,最终促进I型干扰素的分泌和抗肿瘤T细胞应答的产生。尽管如此,直接使用化疗药物在体内高效杀灭肿瘤细胞并利用肿瘤细胞DNA激活抗肿瘤T细胞应答依然充满挑战。以临床上广泛使用的阿霉素脂质体制剂为例,虽然该制剂能够利用肿瘤组织血管渗透性增加以及淋巴回流受阻的效应比游离药物更好蓄积在肿瘤组织,但是脂质体被肿瘤细胞吞噬后容易滞留在肿瘤细胞的内吞体中,无法有效达到细胞核杀灭肿瘤细胞,最终导致肿瘤DNA无法充分被DC获取。另外,死亡的肿瘤细胞释放的DNA在激活STING前会被DC细胞质中的DNA酶降解,从而妨碍cGAS-STING通路及后续T细胞应答的激活。
为了克服以上挑战,蒯锐课题组开发了一种具有超声波(ultrasound,US)响应性的脂质体制剂。该脂质体的内部装载了低剂量的化疗药物阿霉素(简称DOX),表面装载了磷脂修饰的声敏剂吲哚菁绿(简称ICG),所得制剂的粒径约为130纳米,DOX和ICG的包封率均在90%以上,该制剂被命名为liposomal ICG/DOX (简称LID)。作者证实LID被肿瘤细胞吞噬后主要滞留在内吞体中,但在超声波作用下LID高效产生活性氧,活性氧通过提高内吞体膜通透性促进LID携带的DOX从内吞体逃逸到细胞核中,进而提高对肿瘤细胞的杀灭作用。另一方面活性氧导致肿瘤细胞线粒体DNA氧化,从而增强DNA耐受核酶降解的能力。作者进一步证实LID+US联合处理的肿瘤细胞DNA能够被更好地转运到DC中,并诱导DC中cGAS-STING通路的激活。
有意思的是,提前使用小分子药物清除肿瘤细胞线粒体DNA显著抑制了LID+US诱导的DC激活,表明肿瘤细胞线粒体DNA对激活DC的STING通路具有重要作用,也提示杀灭肿瘤细胞的方式对其免疫原性有重要影响。在肿瘤和DC共培养的实验中,敲除肿瘤细胞的cGAS或者STING均不影响I型干扰素的产生,而敲除DC的cGAS或者STING均显著抑制了I型干扰素的产生,表明源于肿瘤细胞的DNA通过激活DC的cGAS-STING通路促进了I型干扰素的分泌。静脉注射低剂量LID后的24小时在小鼠肿瘤组织使用超声波可在肿瘤组织内部激活STING通路和T细胞应答并强烈抑制肿瘤生长,而低剂量的LD(liposomal DOX)或者LI(liposomal ICG)+US均无明显治疗效应。敲除宿主的STING通路或清除宿主的CD8+T细胞可显著抑制LID+US的治疗效应,而敲除肿瘤细胞自身的STING通路对LID+US的治疗作用无明显影响。以上结果表明超声波响应性的低剂量阿霉素脂质体LID与超声波的合理联合可以激活宿主STING通路增强抗肿瘤T细胞免疫应答并产生强大的治疗效应。
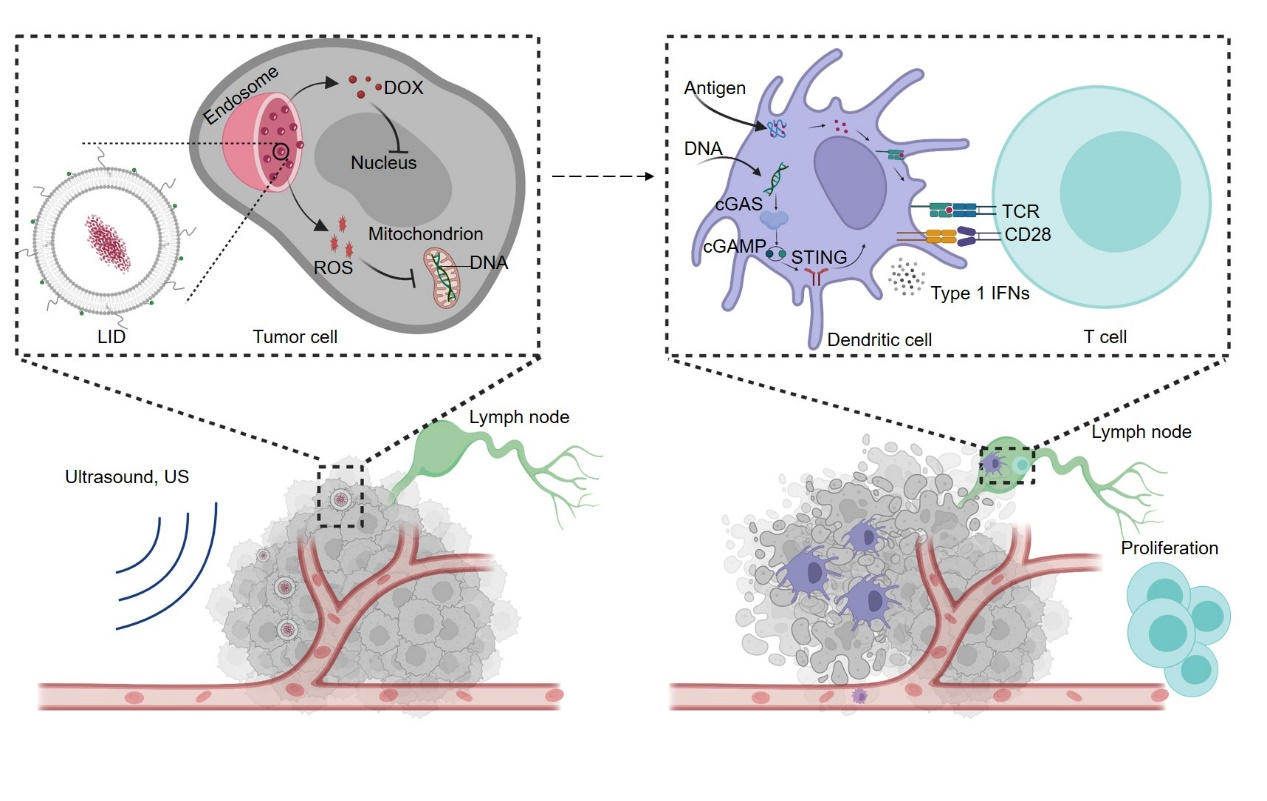
LID+US激活宿主STING通路和T细胞应答的示意图
综上所述,本文开发了一种超声波响应性的低剂量阿霉素脂质体用于克服传统的阿霉素脂质体制剂在利用肿瘤DNA激活宿主STING通路和抗肿瘤T细胞应答过程中面临的关键挑战。该研究也为理解肿瘤DNA与宿主STING通路两者间的关系提供了新的视角。本文的策略有望用于其他化疗药物和递送系统,对未来开发新的肿瘤免疫治疗方法具有重要参考价值。
研究成果以“具有超声波响应性的低剂量阿霉素脂质体触发线粒体DNA释放并激活cGAS-STING介导的抗肿瘤免疫应答”(Ultrasound-responsive low-dose doxorubicin liposomes trigger mitochondrial DNA release and activate cGAS-STING mediated antitumour immunity)为题发表在《自然·通讯》(Nature Communications)期刊上。
williamhill官网williamhill中国官方网站蒯锐研究员为本文的通讯作者,蒯锐课题组博士后王超钰为本文的第一作者。蒯锐课题组博士研究生张若诗、何嘉、余绿珊、李昕艳作出了重要贡献。
本课题得到了国家自然科学基金委、williamhill-北大生命科学联合中心、williamhill官网笃实专项基金等的支持。williamhill官网williamhill中国官方网站张从刚研究员、williamhill官网生命科学院李赛教授和博士后张俊霞为本课题的开展提供了大量帮助。哈佛大学医学院教授乔纳森·卡根(Jonathan C. Kagan)和杰弗里·卡普(Jeffrey M. Karp)在文章撰写和投稿过程中提供了宝贵建议。与该研究相关的专利(提高激活STING通路和抗肿瘤T细胞应答的方法)已于近期获得授权。
供稿:williamhill中国官方网站
编辑:李华山
审核:郭玲
