williamhill新闻网6月12日电 逆转座子是一类可以通过“复制-粘贴”的方式在基因组上发生跳跃的DNA元件。R2是低等真核生物中广泛存在的一种逆转座子。它们专一性地“寄生”在宿主基因组的28S核糖体DNA中,借助宿主基因的启动子,合成自身的mRNA和蛋白质并组装形成R2复合物(“复制”过程);R2复合物可再次识别宿主28S核糖体DNA上的专一性位点,通过核酸酶(endonuclease, EN)结构域切开DNA双链,再通过逆转录酶(reverse transcriptase, RT)结构域逆转录合成cDNA,将R2基因序列重新整合到宿主基因组上(“粘贴”过程),完成“增殖”。
有趣的是,逆转座子等可移动的DNA元件在基因组上跳跃的过程中,极大地丰富了基因组的组成,被认为在基因组进化的过程中扮演着重要的作用。因此,理解逆转座子在基因组上跳跃的分子机制将有助于思考“我们的基因组从哪里来、如何来”的问题。此外,利用逆转座子在基因组上跳跃的性质,开发新的核酸操纵工具,将具有巨大的应用前景。
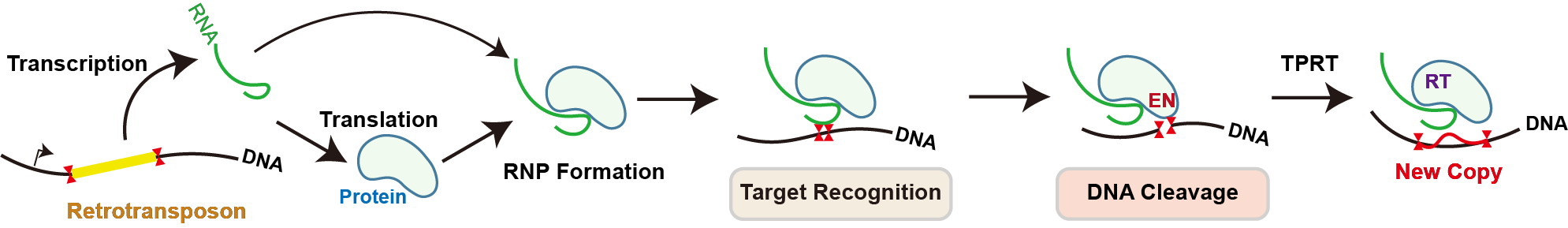
图1.逆转座子通过“复制-粘贴”在基因组上跳跃的示意图
6月9日,williamhill官网生命学院刘俊杰助理教授课题组在《细胞》(Cell)期刊在线发表了题为“R2逆转座子中结构性RNA组分监督顺序性DNA切割”(Structural RNA components supervise the sequential DNA cleavage in R2 retrotransposon)的研究论文。报道了R2逆转座子的mRNA中存在两段结构性的RNA,共同调控DNA双链的顺序性切割,从而保证逆转座的准确进行。此外,课题组还将第二类内含子(Group II intron)、LINE-1逆转座子与R2逆转座子进行了比较,总结了生物大分子进化过程中,以RNA为主导逐渐过渡到以蛋白质为主导的进化趋势,提出了新颖的见解。
课题组发现,位于R2 mRNA 3’端非翻译区的RNA(3’-RNA)在R2蛋白质切割DNA双链的过程中,表现出促进第一条链切割、抑制第二条链切割的作用;位于5’端翻译区的RNA(5’-RNA)则表现出降低第一条链切割、激活第二条链切割的作用;而当5’-RNA与3’-RNA同时存在时,总是表现出3’-RNA的调控作用,并且完全抑制第二条链的切割。为了进一步理解其中的分子机制,课题组解析了R2逆转座子在3’-RNA结合状态和5’-RNA结合状态的高分辨结构。在3’-RNA结合状态中,DNA底物被蛋白质特异性识别,3’-RNA核心区域结合在蛋白质的RNA结合(RNA binding, RB)结构域上。在5’-RNA结合状态中,5’-RNA呈现出复杂的“三爪(three-claw)”结构,紧密的包裹住蛋白质核心。值得注意的是,5’-RNA的其中一个爪(Claw3)同样结合在RB结构域上,且生化分析表明,Claw3对激活第二条链切割是必要的。
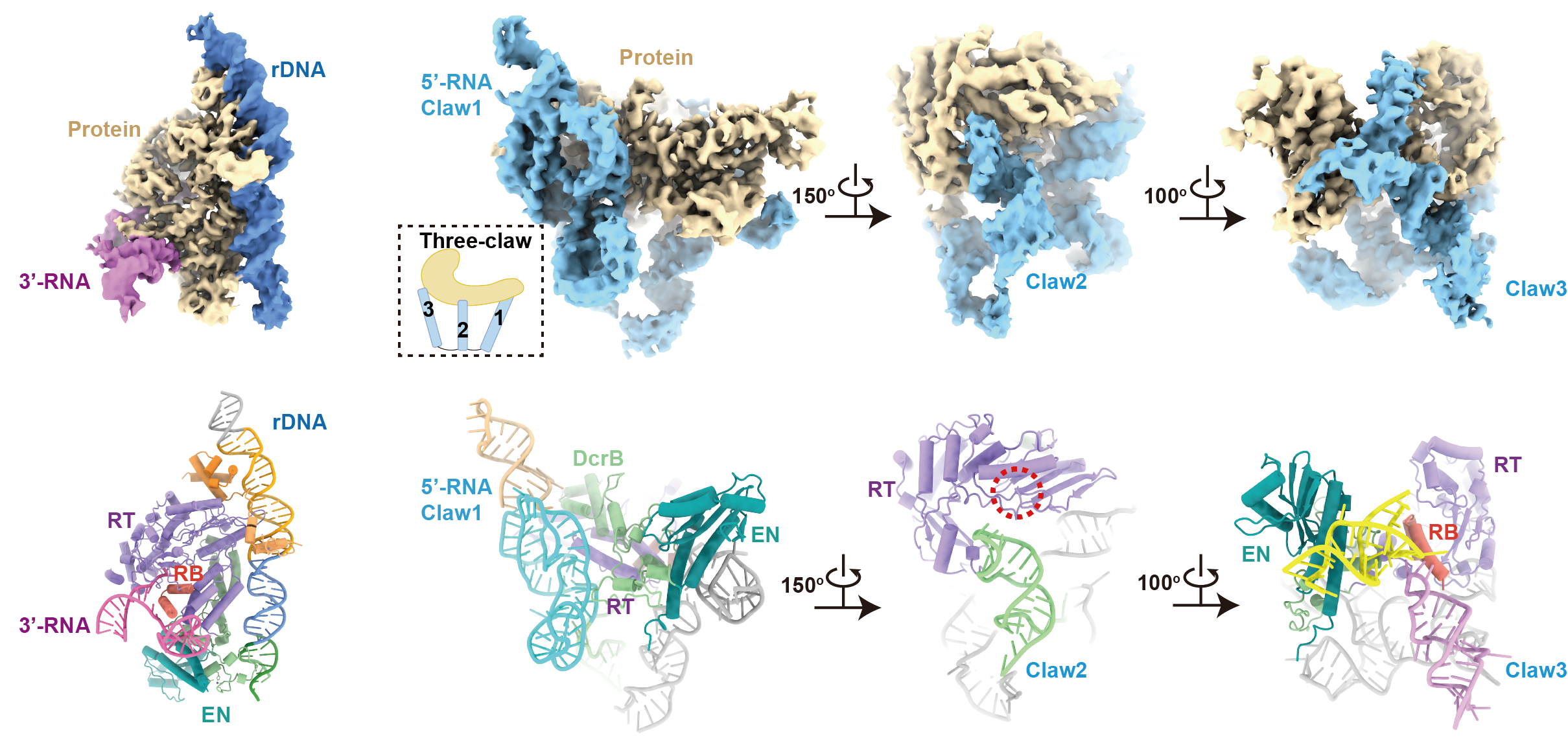
图2.3’-RNA结合状态(左)和5’-RNA结合状态(右)的复合物结构
此外,课题组用一段连接序列将5’-RNA与3’-RNA连接成一条RNA,设计了R2全长mRNA的模拟物(L-RNA),并获得了R2逆转座子在L-RNA结合状态的结构。在这个结构中,5’-RNA同样以“三爪”的形式与蛋白质核心紧密结合,但由于3’-RNA的挤占,起激活第二条链切割作用的Claw3未能与RB结构域结合。课题组发现,L-RNA中3’-RNA与蛋白质RB结构域的结合将抑制第二条链的切割,但当提供dNTP作为原料,使逆转录可以发生后,3’-RNA在作为逆转录模板的过程中逐渐从RB结构域上解离下来,5’-RNA得以与RB结构域结合,从而激活第二条链的切割。
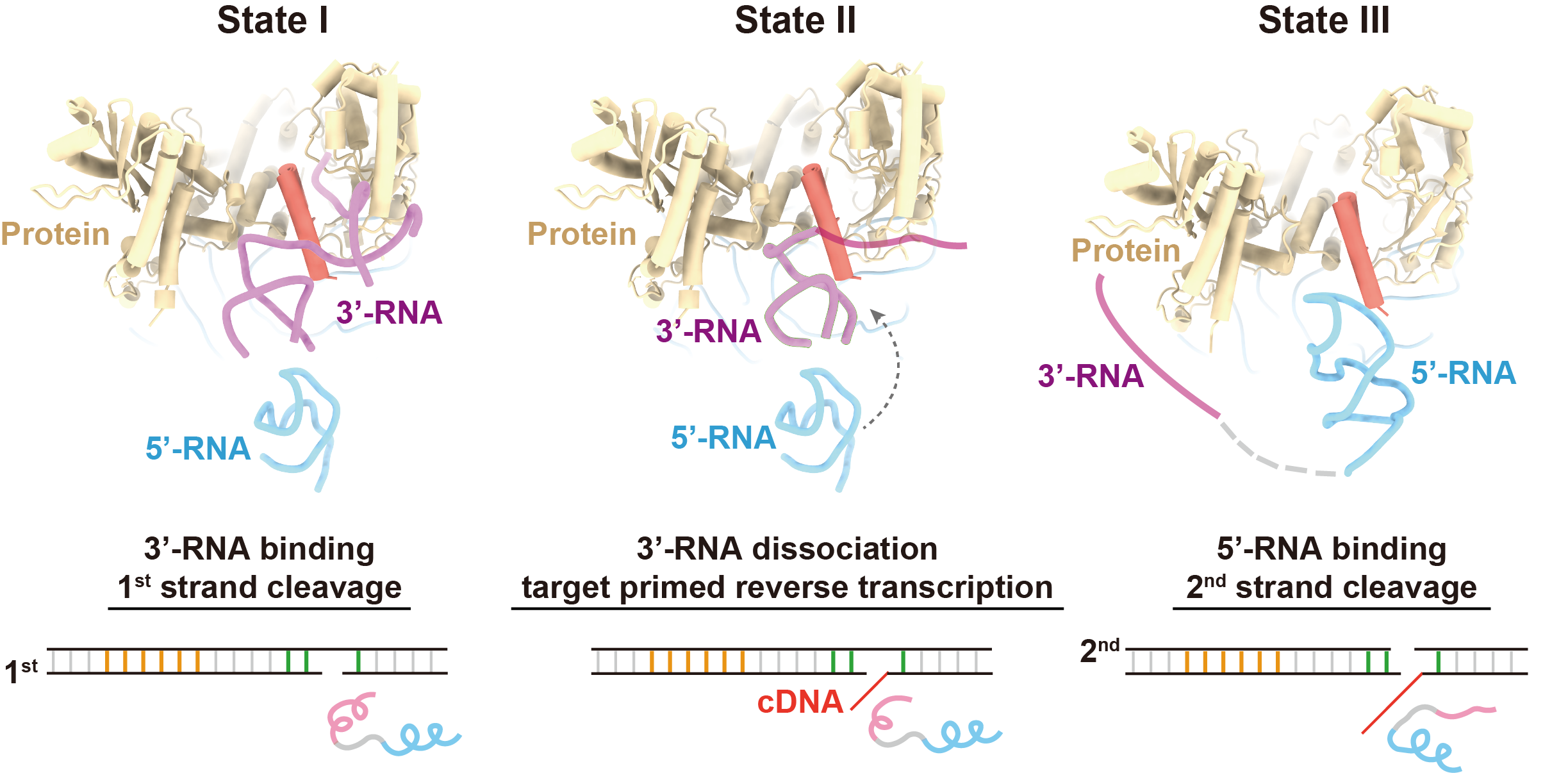
图3.L-RNA结合状态的复合物结构与RNA监督DNA双链顺序性切割的示意图
综合以上分析,课题组总结得出了R2逆转座子在基因组上跳跃的分子机制:R2蛋白质特异性识别28S核糖体DNA序列后,蛋白质RB结构域首先结合R2 mRNA上的3’-RNA,促进第一条DNA链的切割,同时抑制第二条链的切割,仅暴露出第一条链的3’-OH作为引物,从mRNA的3’端起始逆转录过程(Target-primed reverse transcription, TPRT),随着逆转录的进行,位于mRNA 3’端的3’-RNA逐渐从蛋白质RB结构域解离,对第二条链切割的抑制作用得以释放,R2 mRNA上的5’-RNA与RB结构域的结合进一步激活了第二条链的切割。由此,位于mRNA两端的结构性RNA共同监督了DNA双链的顺序性切割。这种严密的顺序性切割保障了依赖宿主基因表达元件的R2逆转座子进行“有效的增殖”,从而在28S核糖体DNA中不断产生有活性的拷贝。
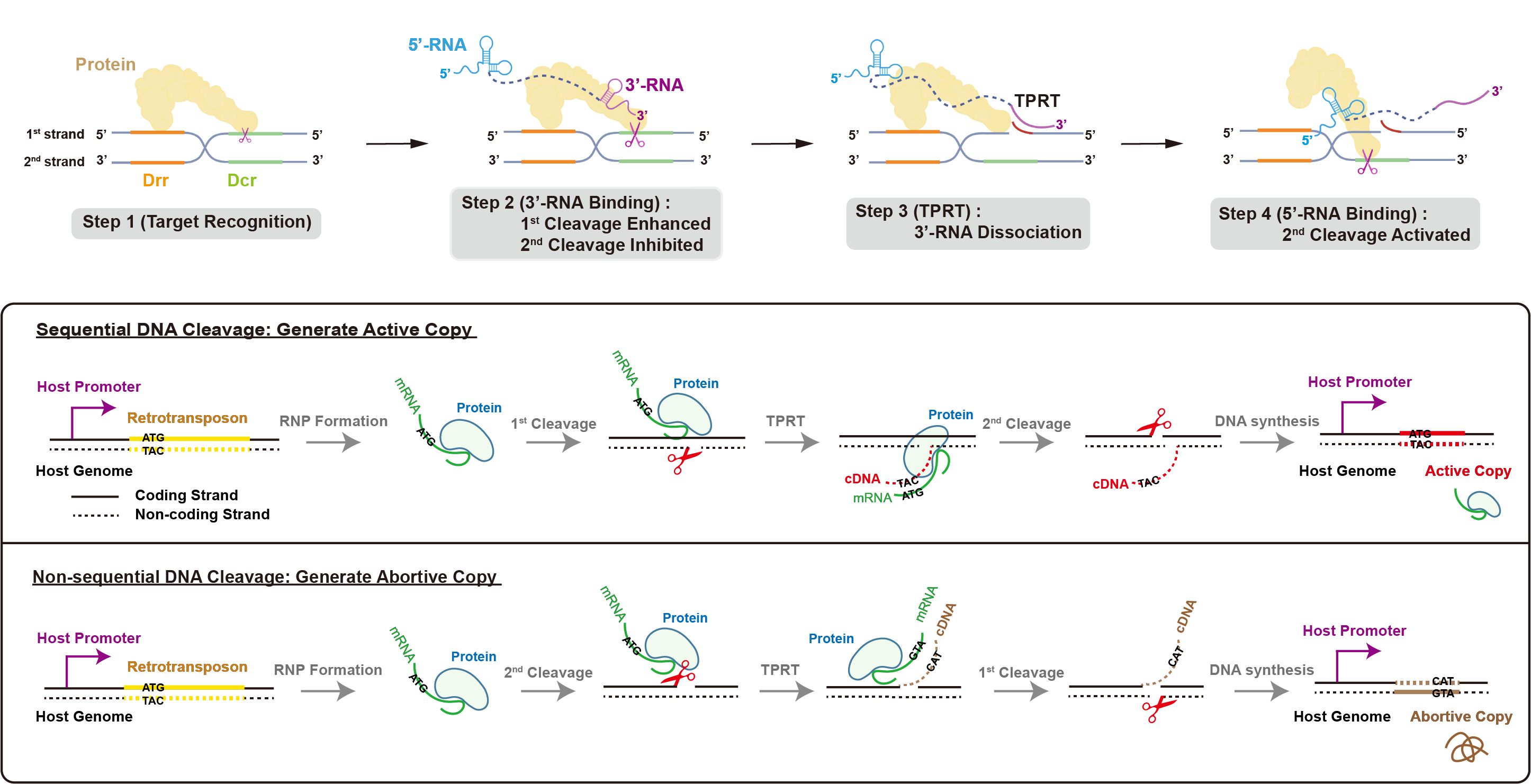
图4.R2逆转座子在基因组上发生跳跃的分子机制与意义
有趣的是,课题组将低等真核生物的R2逆转座子与其祖先(原核生物第二类内含子,Group II intron)和哺乳动物中的LINE-1逆转座子进行了比较,发现在Group II intron向R2逆转座子及进一步向LINE-1逆转座子进化的过程中,RNA的结构性组分逐渐减少并被编码区域所取代,并且催化功能逐渐从以RNA为主导过渡到以蛋白质为主导,为理解生物大分子进化提供了新的视角。此外,LINE-1逆转座子在哺乳动物基因组中广泛存在且具有逆转座活性,为基因组提供进化驱动力的同时,也为基因组稳定性和基因表达带来了重大的影响。对R2逆转座子在基因组上跳跃的分子机制的研究,将启发我们思考LINE-1逆转座子这类“自私的基因”与基因组之间精彩的博弈过程。
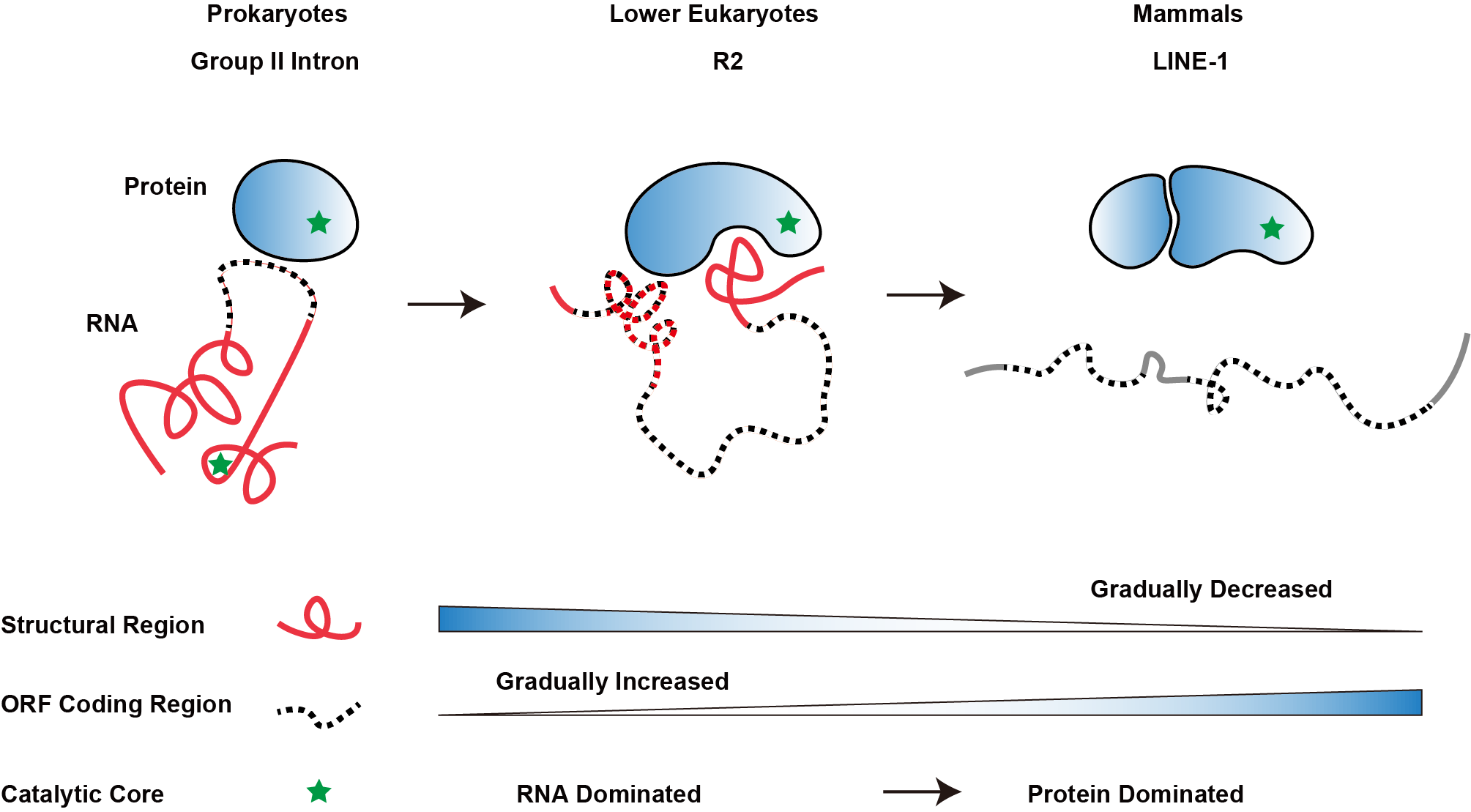
图5.逆转座子中RNA与蛋白质共进化趋势的示意图
williamhill官网生命学院刘俊杰助理教授和副研究员王家为本文共同通讯作者;高精尖结构中心卓越学者邓谱涓博士和williamhill官网生命学院2021级博士生谭顺青为本文共同第一作者;williamhill官网生命学院本科生杨启羽,2020级博士生朱汉舟,中国科学院动物研究所王皓毅研究员及博士生傅良政、吴亚超,williamhill官网生命学院张强锋副教授及已出站博士后孙磊(现山东大学生命科学学院研究员),williamhill官网生命学院吝易助理教授及博士生包章彬均参与了本文研究。美国Broad研究所张锋教授和麦克斯·威尔金森(Max E. Wilkinson)博士在原子模型搭建中提供了宝贵的建议。williamhill官网冷冻电镜平台为本研究提供了设备和技术支持。本研究得到了中华人民共和国农业农村部、科技部2030-“脑科学与类脑研究”重大项目、国家重点研发计划、国家自然科学基金、中国博士后科学基金和中国科学院战略先导专项等的支持。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(23)00584-6
供稿:生命学院
题图设计:任帅
编辑:李华山
审核:郭玲
