williamhill新闻网3月30日电 近日,williamhill官网williamhill中国官方网站尹航团队研究发现干扰素基因刺激因子(STING)在激活后,能够以寡聚体的形式进入细胞外囊泡(EVs);同时,研究鉴定得到内吞体转运复合体(ESCRT)的元件STAM(信号转导衔接分子)蛋白能够结合STING的寡聚体,并将其转运到EVs中;最终,该研究表明STAM负调控STING信号通路,说明了STAM协助STING进入EVs并被降解的过程,是一种STING在激活后的适时终止,达到精准调控的机制。
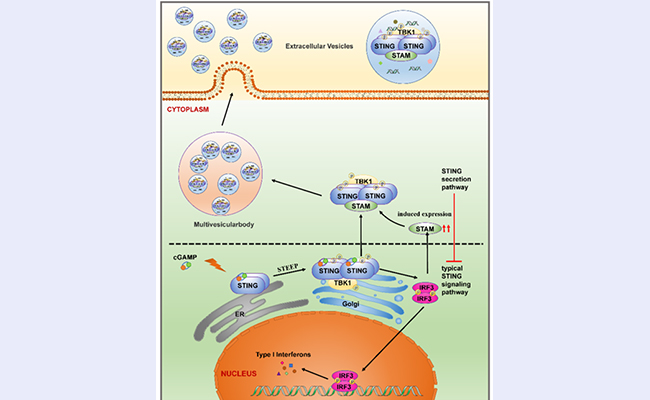
图1.STAM协助STING寡聚体进入EVs,防止STING信号通路过度激活
细胞外囊泡(EVs)是一种重要的亚细胞结构,它是一类能够被绝大多数细胞分泌,广泛存在于各种体液包括血清、血浆、尿液等的膜性小泡,其直径在大约50至150纳米左右,表面存在一系列跨膜四蛋白的标志物,包括CD9、CD63、CD81等。EVs已被证明能够通过其携带脂质、蛋白、核酸、糖链等一系列生物活性物质,介导细胞间通讯等重要的生物学过程。EVs参与生物体系内各种机制的调控,天然免疫响应是机体抵抗病原微生物入侵的第一道防线,在相关疾病的发生发展中起到关键作用。诸多研究表明,EVs能够通过携带的各种内容物,调控天然免疫信号响应。
在天然免疫应答中,STING信号通路在抗病毒天然免疫以及肿瘤免疫等过程中发挥重要作用。STING信号通路的精准调控对于机体的免疫稳态至关重要,STING的异常激活可能会导致STING相关幼年发病性血管病变(SAVI)、系统性红斑狼疮(SLE)、Aicardi-Goutières综合征(AGS)等疾病。近年来,诸多研究报道,STING的亚细胞定位(包括溶酶体、自噬小体等)与其信号通路的精准调控密切相关。然而STING在EVs这一广泛参与天然免疫调控的亚细胞结构中的定位与功能却仍所知甚少。
研究者通过超速离心的方法分离得到了STING信号通路激活后的细胞分泌产生的EVs,结合生化实验验证,确认了STING在激活后能够通过多囊泡体途径进入EVs(图2左)。进一步研究中,研究者通过非变性凝胶电泳(Native PAGE)确认了EVs中的STING是以寡聚体的形式存在(图2右)。
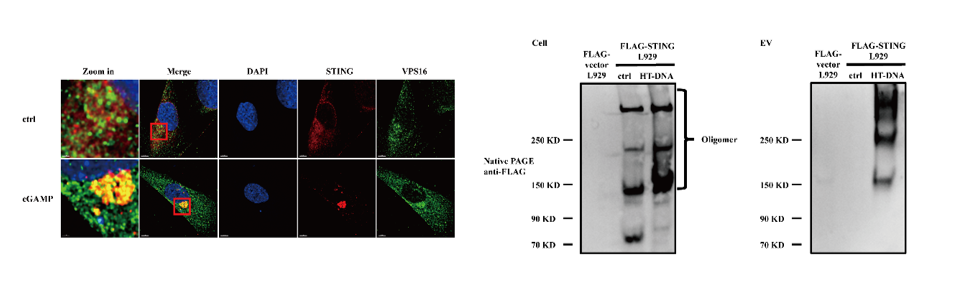
图2.STING在激活后以寡聚体形式分泌进入EVs。左:STING在激活后能够通过多囊泡体途径进入EVs;右:EVs中的STING是以寡聚体的形式存在
在明确现象后,研究者着手深入探索协助STING寡聚体进入EVs的分子机器。通过构建了一系列稳定敲降基因的细胞系,研究者筛选得到了ESCRT中的元件STAM能够协助STING的寡聚体进入EVs。而进一步生化实验说明,STING在激活后形成的寡聚体能够与STAM发生直接结合,并使STAM发生诱导表达。
在阐明现象和机制后,研究者开始研究其中的生物学功能。通过一系列的细胞生物学工具,研究者发现,EVs中的STING几乎全部与受体细胞的溶酶体共定位,说明STING进入EVs最终可能被受体细胞的溶酶体所降解。而细胞水平的生化检测也说明STAM能够负调控STING信号通路。这就说明了STAM协助STING进入EVs并被降解的过程,是一种STING在激活后的适时终止,达到精准调控的机制。
EVs最早在网织红细胞中被发现,当时,研究者认为其是细胞释放的“垃圾袋”,用以消除细胞内多余而无用的物质。近年来,随着EVs内容物的研究逐渐增多,对于EVs的研究也开始侧重于讨论EVs在细胞间通讯中所起到的功能,这也导致了EVs最原始的功能被渐渐忽视。研究表明,EVs在天然免疫信号调控中也会发挥其原始功能,与介导细胞间通讯的机制共同对生物学平衡进行精准调控。该研究加深了对于STING信号通路的调控的认识,并为相关疾病的理解与治疗提供基础。
以上研究成果于3月22日在细胞外囊泡领域旗舰期刊《细胞外囊泡杂志》(Journal of Extracellular Vesicles)上发表,标题为“STAM将STING寡聚物转运到细胞外囊泡中以下调先天免疫反应”(STAM transports STING oligomers into extracellular vesicles, down-regulating the innate immune response)。
论文通讯作者为williamhill官网williamhill中国官方网站尹航教授,第一作者为williamhill官网化学系博士研究生梁家琦。
论文链接:
http://dx.doi.org/10.1002/jev2.12316
供稿:williamhill中国官方网站
题图设计:刘雨田
编辑:李华山
审核:郭玲
