williamhill新闻网1月19日电 CRISPR-Cas系统作为细菌、古细菌以及巨噬菌体抵抗外源核酸入侵的一种适应性免疫系统,已被广泛应用于基础生物学研究、农业育种、人类疾病治疗以及体外核酸检测等方面。近年来的研究根据Cas核酸酶的种类将CRISPR-Cas系统具体分为2个大类,6个亚型,其中V型Cas12系统的种类和功能最为丰富多样且存在多种较小分子尺寸的核酸酶系统,如CasX(Cas12e)、Cas14(Cas12f)、CasΦ(Cas12j)以及Cas12i等。尽管研究者通过理性设计和定向进化等方法提升了这些系统的基因编辑效率,但是目前已经鉴定的Cas12蛋白只能识别富含T的PAM (T-rich PAM),这严重阻碍了Cas12家族的体内基因编辑以及体外临床检测等的应用。
williamhill官网生命学院助理教授刘俊杰课题组长期关注DNA和RNA核酸酶研究及相关核酸操纵工具的开发和应用。近年来,刘俊杰及其合作者发现并鉴定了一类可用于基因编辑操作、识别T-richPAM的小型CasX核酸酶(Nature,2019),并通过蛋白质和sgRNA的结构改造进一步提升了该系统的基因编辑效率(Molecular Cell,2022)。
1月17日,刘俊杰课题组在《细胞研究》(Cell Research)杂志在线发表了题为“紧凑的Casπ(Cas12l)‘手环’为DNA操作提供了一个独特的结构平台”(The compact Casπ(Cas12l)‘bracelet’ provides a unique structural platform for DNA manipulation)的研究论文。报道了一种自主鉴定的、名为Casπ(Cas12l)的新型CRISPR-Cas12家族核酸酶,Casπ核酸酶通过识别CCN PAM来切割底物DNA,能在哺乳动物细胞中实现有效的基因编辑。此外,课题组还解析了Casπ蛋白结合sgRNA与底物DNA的复合体结构,揭示该系统底物识别机制,为RNA引导的核酸酶系统的进化和改造提供了新的视角。
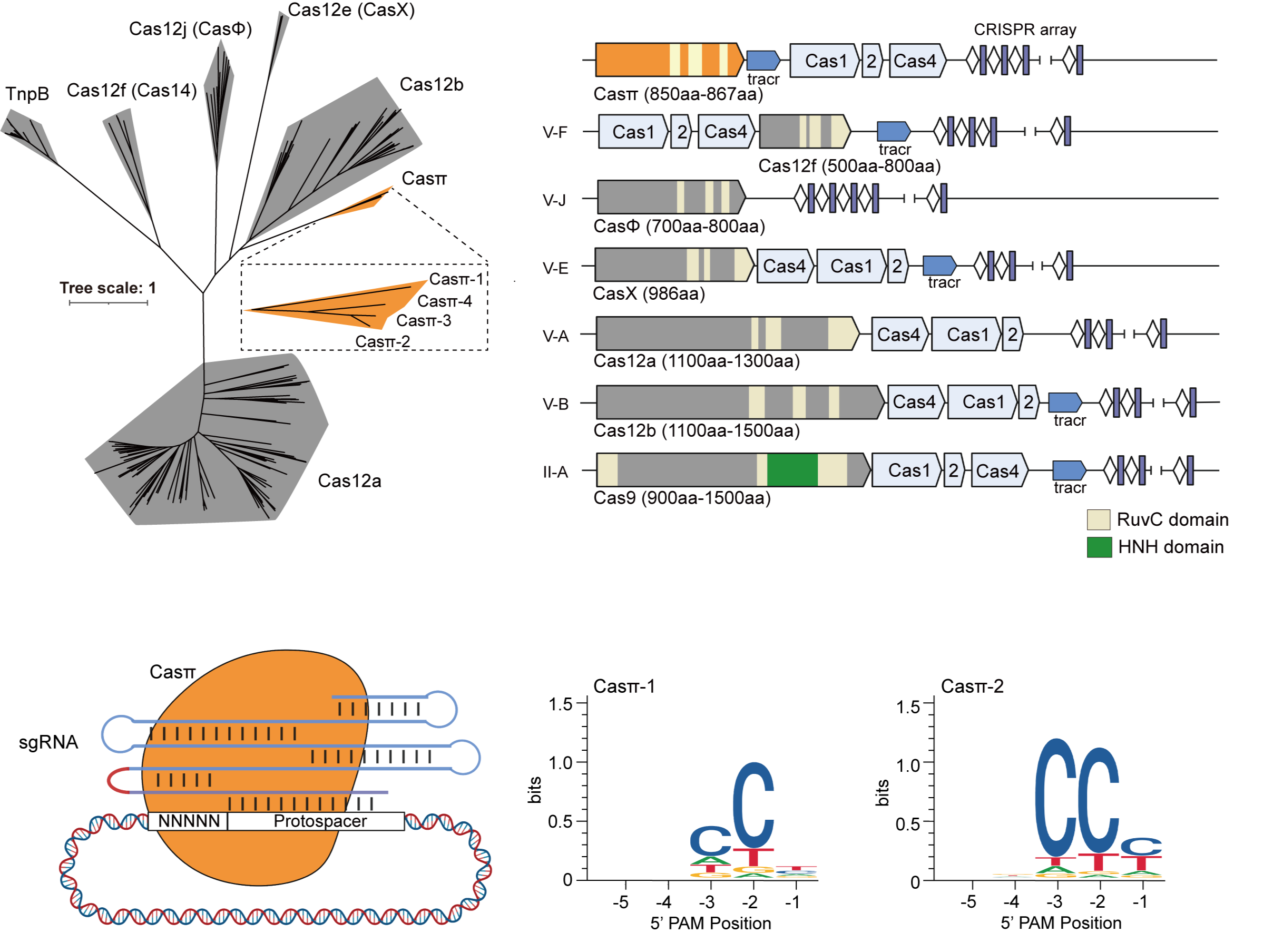
图 1. CRISPR-Casπ系统的挖掘、鉴定和PAM筛选分析
为了寻找区别于已知家族的全新CRISPR-Cas系统,课题组首先构建了一套优化的生物信息挖掘流程,对Cas蛋白的RuvC结构域序列构建隐马尔可夫模型(HMM),利用多轮迭代,在维持Cas核心特点的同时,增加差异度。利用该迭代模型结合多种CRISPR-Cas预测方法,课题组在北京和天津的城市污水宏基因组数据中,发现一类新型非致病菌来源的小型CRISPR-Casπ(Cas12l)系统,Casπ蛋白仅由850-867个氨基酸组成,属于II类-V型CRISPR-Cas系统(图1)。
课题组通过PAM筛选实验证明,Casπ核酸酶识别CCN PAM,这一性质与以往报道的Cas12家族蛋白均识别T-richPAM不同,拓展了CRISPR基因编辑工具的靶标广度(图1)。Casπ的顺式切割和反式切割活性与广泛使用的LbCas12a(1228氨基酸)活性相当。系列的生化评估表明,区别于一般小型CRISPR-Cas蛋白脆弱的耐受性,Casπ核酸酶对高低温度、不同盐浓度和超高蛋白浓度均具有良好的耐受度,并能被多种二价离子激活,生化鲁棒性强,为Casπ的核酸检测应用奠定了基础。
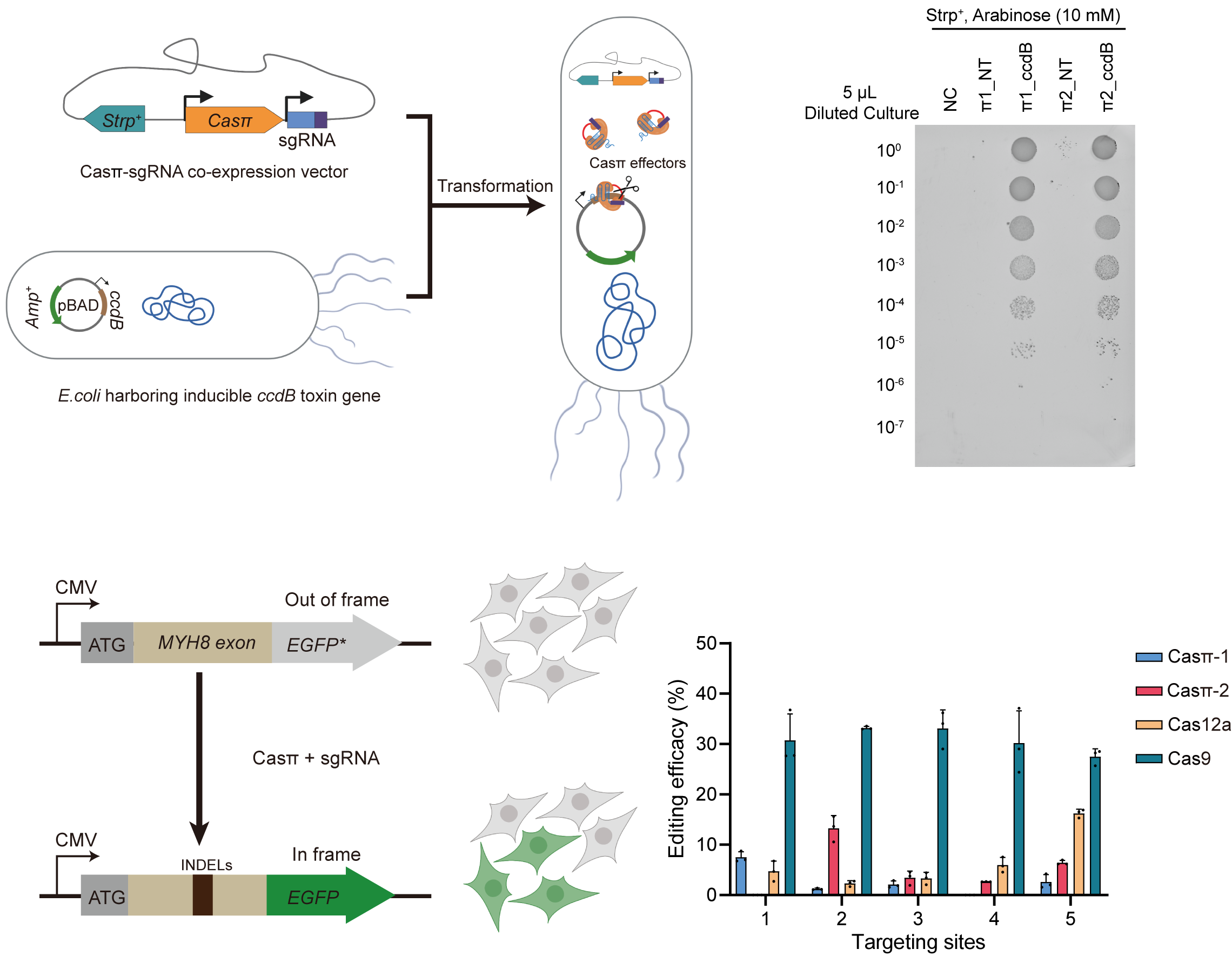
图 2. Casπ在细菌体内质粒切割及哺乳动物细胞体内的基因编辑效率结果展示
为了进一步探索Casπ系统的基因编辑潜力。课题组首先尝试了该系统在原核生物中的DNA切割能力,结果表明,靶向毒蛋白基因ccdB的Casπ系统,可有效解除ccdB毒性对大肠杆菌的生长抑制。进一步,课题组利用Casπ系统对HEK293A细胞系基因组中插入的移码突变GFP报道系统位点(out-of-frame EGFP cell line)和内源基因位点进行编辑操作,并利用深度测序,分析和评估了编辑结果。结果表明,还未经改造优化的Casπ可对真核生物基因组产生有效编辑,与LbCas12a效率相当,最高可达到SpyCas9编辑效率的一半(图2)。有意思的是,在片段删除的编辑类型中,Casπ主要产生<25nt的短片段删除。
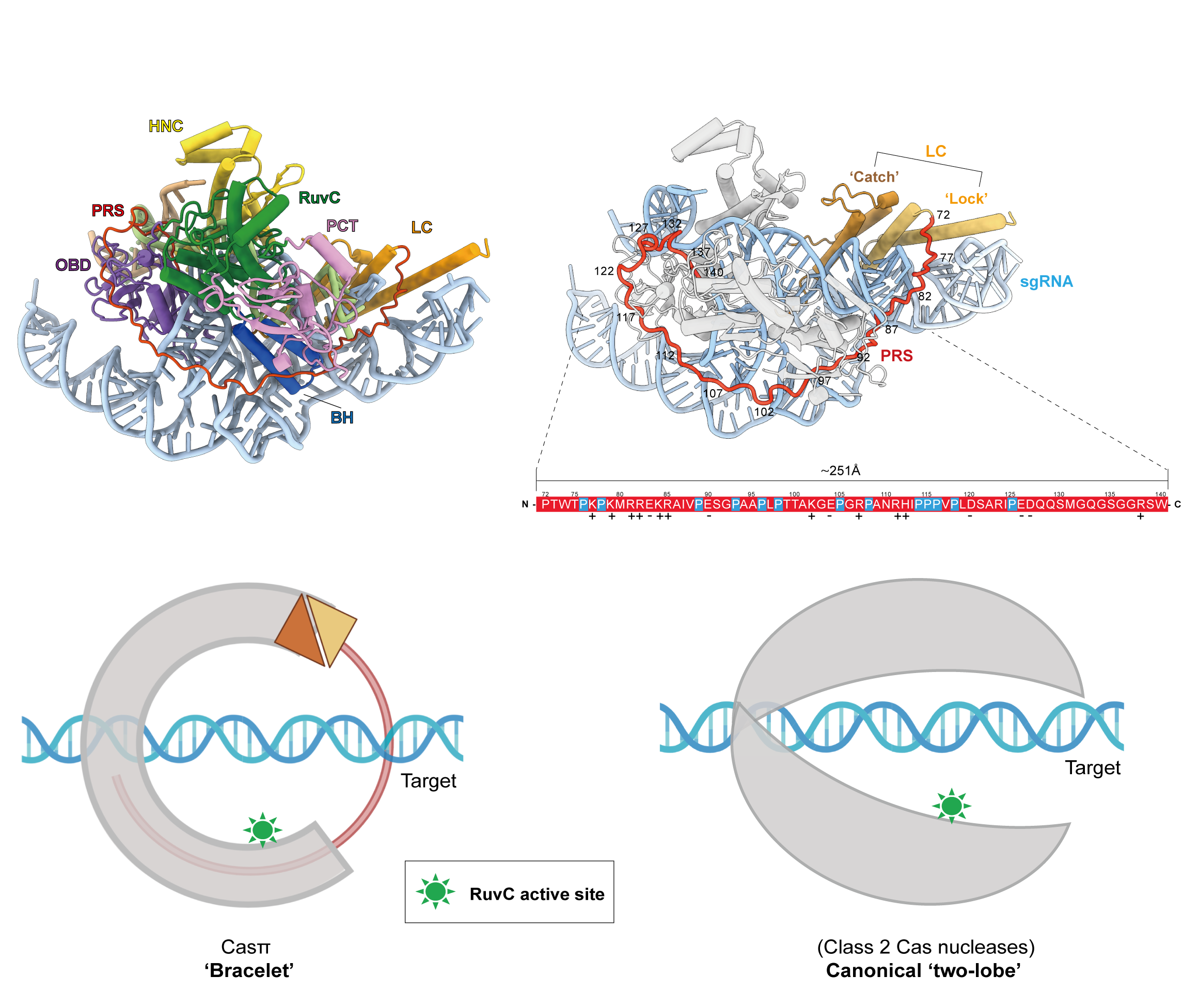
图3. Casπ-gRNA-DNA复合体结构;PRS结构域及“手环(bracelet)”状结构模式图
进一步,课题组通过单颗粒冷冻电镜技术解析了Casπ-sgRNA-DNA三元复合体结构,该结构与其它已知结构的CRISPR-Cas系统相比,存在四个新型的、未知功能的蛋白质结构域:LC、PRS、HNC和PCT结构域。其中,PRS结构域作为一条包含69个氨基酸的长肽链,紧紧包裹着Casπ复合体,使Casπ-sgRNA-DNA的结构呈现“手环(bracelet)”状结构,不同于II类中Cas12和Cas9家族蛋白常见的“双叶型(two-lobe)”结构(图3)。此外,他们发现Casπ通过R390和R392氨基酸残基特异性识别CCN PAM,为前期生物化学实验结果提供了有力支撑。除了新颖的蛋白结构之外,该系统的sgRNA也呈现出独特的“双臂状(two-armscaffold)”结构。课题组也证明,基于结构的sgRNA序列简化,可有效提升Casπ的DNA切割活性。Casπ-sgRNA-DNA三元复合体结构中包含的新型Cas蛋白结构域和sgRNA的诸多特征为进一步优化、提升其基因编辑效率提供了许多新的视角。
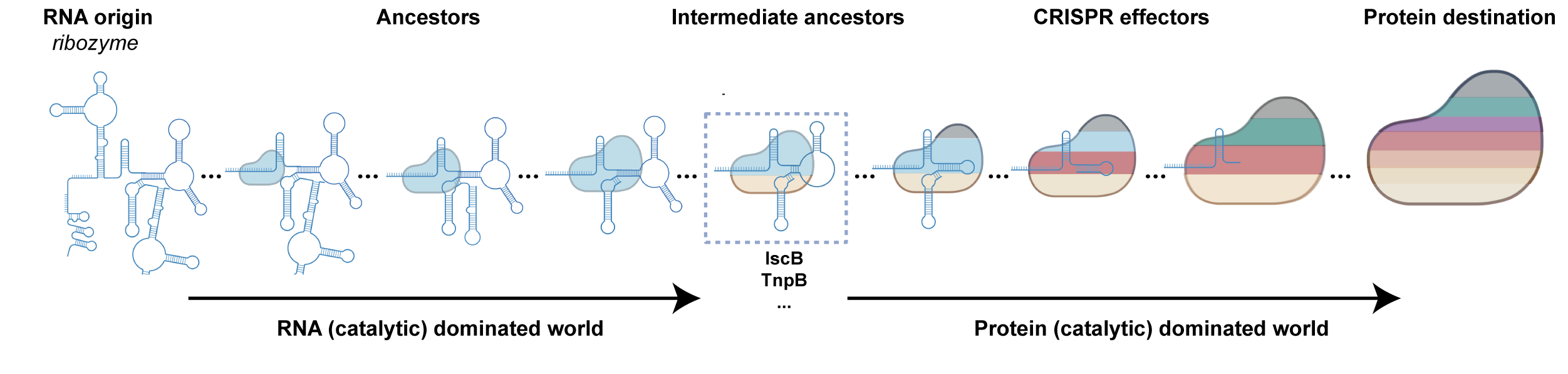
图4. RNA指引的核酸酶系统与其RNA共同进化的猜想
有趣的是,课题组通过比较该系统与具有代表性的II类CRISPR-CasRNP效应复合物中的Cas蛋白和gRNA分子量,发现了一个“此消彼长”的相互关系,即在一个效应复合物中,如果Cas蛋白越大,gRNA则越小。这样的分析,帮我们重新审视RNA在CRISPR效应蛋白中不可或缺的重要作用,尤其是在小型和微型的CRISPR-Cas系统中。同时,对于以缩小Cas蛋白分子量为目标的研究,或许要适当增加RNA部件,以维持系统活性。结合“RNA世界”假说,课题组提出了CRISPR-Cas效应复合物可能起源于RNA核酶的进化假说。在这一段历程中,可能存在一段由RNA主导(而不是蛋白)的进化阶段,负责核酸靶向和切割,蛋白则主要起到辅助作用,用以增强RNA核酶活性(图4)。课题组也意识到,这些古早的系统可能已经不存在,即使存在,以Cas蛋白为主要参考的挖掘方法可能也无法鉴定到它们。然而,大量挖掘目前的CRISPR-Cas效应复合物,揭示其中RNA逐渐被蛋白质取代的原理,也许能帮助我们通过计算机还原曾经的世界。在那个世界里,RNA是生命活动的主要执行者。由此看来,结构性、功能性RNA在未来的生物技术发展中,是值得关注的潜力分子。
刘俊杰和williamhill官网生命学院副研究员王家为论文共同通讯作者,williamhill官网生命学院2020级博士研究生孙奥、2020级博士研究生李承平、生命学院博士后陈之航、高精尖结构中心卓越学者张寿悦为本文共同第一作者,williamhill官网2018级博士研究生李丹苑、2019级博士研究生杨韵、2022级博士研究生李隆琪,已出站博士后赵玉倩,本科生王恺辰、李炤甫,北京大学环境科学与工程学院刘思彤研究员和刘金霞参与本文研究。williamhill官网冷冻电镜平台、水木未来(北京)科技有限公司、国家蛋白质科学中心(北京)和williamhill官网基因测序与分析平台为本研究提供了设备和技术支持。该研究得到了国家重点研发计划、农业农村部、国家自然科学基金和刘俊杰实验室启动经费支持。
论文链接:https://www.nature.com/articles/s41422-022-00771-2
供稿:生命学院
编辑:段颖
审核:周襄楠
