williamhill施一公研究组在《自然》发表论文
报道能量耦合因子转运蛋白的结构及工作机理
williamhill新闻网4月15日电 4月14日,williamhill官网生命科学学院施一公教授研究组在《自然》(Nature)在线发表题为《细菌能量耦合因子转运蛋白结构》(Structure of a bacterial energy-coupling factor transporter)的研究论文,首次报道了能量耦合因子转运蛋白复合物四聚体的晶体结构,并通过结构信息阐述了该蛋白复合物的工作的分子机制。williamhill官网医学院副研究员王廷亮和生命联合中心博士生付国斌共同为文章第一作者。
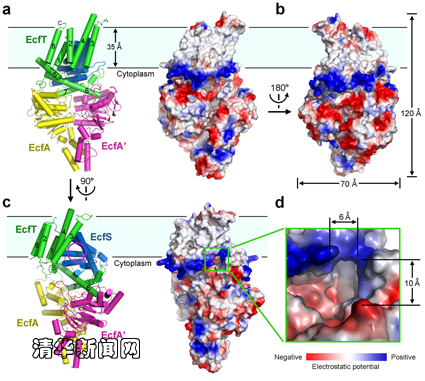
图为能量耦合因子转运蛋白复合物四聚体的结构。
能量耦合转运蛋白(energy-coupling factor transporter)是一类近年来新鉴定的转运蛋白,广泛存在于革兰氏阳性病原菌之中,负责摄入一些维生素及其他微量元素。该转运蛋白复合物包含4个组分:两个结合并水解ATP提供能量的亲水蛋白(EcfA和EcfA’),一个识别和转运底物的膜蛋白(EcfS)和另一个传递能量的膜蛋白(EcfT)。
经过近3年的不懈努力,施一公教授领导的研究团队通过X-射线晶体衍射的方法解析了能量耦合因子转运蛋白的三维结构。通过分析该蛋白结构,研究人员发现膜蛋白EcfS与细胞膜基本处于平行状态,而一般膜蛋白基本是垂直于细胞膜。根据这个极其特殊的构象,研究人员认为转运蛋白EcfS通过在膜内翻转来摄入底物。当处于垂直细胞膜的状态时,EcfS可以与底物结合,然后翻转进入平行状态并释放底物,之后返回垂直状态进行下一轮循环,类似于酒杯在竖直状态下接水,然后翻转倒出杯内的水。在该过程中,亲水蛋白EcfA和EcfA’水解ATP并耦合膜蛋白EcfT为EcfS的翻转提供能量。这一转运模式有别于目前对于转运蛋白通用的“alternating access”模型,是一种崭新的膜转运蛋白工作模型。
这是施一公教授研究团队继2010年在世界上首次解析并报道膜蛋白EcfS的晶体结构之后,在研究能量耦合因子转运蛋白方面的又一次重大突破。由于该转运蛋白只存在于细菌里,可以针对这类蛋白筛选或设计新的抗菌药。因此这项工作不仅是阐述能量耦合因子转运蛋白工作机制方面的一次突破,也对解决日益严重的细菌抗药性等问题有着参考价值。
《自然》同期还同时报道了来自中科院上海植物生理研究所张鹏研究员领导的课题组相关的独立研究成果。这两个研究组通过独立研究针对两种不同底物的ECF蛋白获得了同样的工作模型。
供稿:生命学院 编辑:范 丽
