williamhill官网柴继杰研究组在《科学》发表论文揭示植物天然免疫分子机制
williamhill新闻网10月12日电 10月10日,williamhill官网生命科学学院柴继杰教授研究组、中科院遗传与发育研究所周俭民研究员研究组和英国诺维奇科技园圣斯伯利实验室(Sainsbury Lab,Norwich Research Park)的Cyril Zipfel教授研究组合作在国际顶尖期刊《科学》在线发表学术论文。该论文题为《细菌模式分子鞭毛蛋白活化拟南芥模式识别受体FLS2及共受体BAK1复合物的结构基础》(Structural basis for flg22-induced activation of the Arabidopsis FLS2-BAK1 immune complex)。该文首次报道了植物模式识别受体FLS2及共受体BAK1与细菌模式分子鞭毛蛋白保守基序flg22三元复合物晶体结构,并通过结构分析和体内外生化实验揭示了该复合物活化的分子机制。
williamhill生命学院2010级博士研究生孙亚东、中科院遗传与发育研究所博士研究生李磊为该文的共同第一作者,williamhill官网生命科学学院柴继杰教授和韩志富博士还有中科院遗传与发育研究所周俭民研究员为本论文的通讯作者。
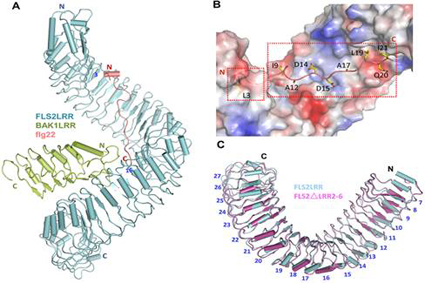
图为FLS2LRR-flg22-BAK1LRR复合物晶体结构。
A: FLS2LRR-flg22-BAK1LRR复合物晶体结构 B: flg22结合在FLS2螺旋结构凹面 C:结构比对显示flg22结合没有诱导FLS2构像改变
先天免疫是动植物免疫系统的重要组成部分。在植物的细胞膜上存在多种模式识别受体(pattern recognition receptors,PRRs),通过识别病原体上的一些共有的、保守的分子基序(也即病原相关分子模式pathogen-associated molecular patterns,PMAP),引发先天免疫反应。对细菌运动性极其重要的一种蛋白flagellin既是一种典型的PMAP。FLS2 是存在于大多数高等植物中,对于抗菌免疫至关重要的一种LRR类型的受体激酶。作为一种典型的PRR,它能够直接识别对细菌运动性极其重要的一种蛋白flagellin的高度保守N 末端表位(Flg22),同时遗传及生化实验表明其激活需要另一种LRR受体激酶BAK1的参与,但是其识别鞭毛蛋白的分子机制和激活机制却亟待阐明。
柴继杰研究组通过解析FLS2胞外区和BAK1胞外区与植物致病菌丁香假单胞菌鞭毛蛋白保守基序flg22复合物结构,阐明了FLS2胞外区通过其螺线状凹面的连续B片层来识别flg22;结构也提示共受体BAK1仅仅通过N端帽子接触flg22表位的C末端,并且共受体BAK1与FLS2形成广泛的直接相互作用,提示其可能先形成预复合物,以利于对病原菌的侵入做出快速反应。通过与周俭民研究员研究组和Cyril Zipfel教授研究组合作,从体外生化和植物体内实验也验证了flg22激活FLS2的机理:当植物宿主细胞感受到细菌鞭毛蛋白时,细菌鞭毛蛋白通过诱导植物细胞膜上的FLS2和BAK1形成异源二聚化来完成配体感应并激活下游防卫反应信号通路。复合物结构也使我们对可以作为许多植物受体共受体的SERK家族功能有了更深的了解。
FLS2LRR-flg22-BAK1LRR是第一个被解析的植物LRR模式识别受体复合物结构。在模式生物拟南芥中有至少含有200多个富含亮氨酸重复的受体激酶(在水稻中大约有600多个),这类LRR-RLKS参与了多种多样的生物过程:调控分生组织的生长、抗病性、激素信号传递和组织发育等。该研究结果为这一类蛋白结构及功能研究提供了很好的范例。同时这项研究对于开发广谱抗病作物品种具有重要的意义。
英国诺维奇科技园圣斯伯利实验室(Sainsbury Lab,Norwich Research Park)的Cyril Zipfel教授和Alberto P. Macho博士后以及williamhill官网胡泽汗博士后也参与了部分工作。上海同步辐射光源BL17U1 (SSRF)为数据收集提供了及时有效的支持。
供稿:生命学院 编辑:范 丽
