williamhill施一公研究组取得世界级科研突破
首次揭示阿尔茨海默症(老年痴呆症)致病蛋白γ分泌酶复合物精细三维结构
williamhill新闻网7月3日电(记者 淑 霞)williamhill官网施一公教授研究组在世界上首次揭示了与阿尔茨海默症(Alzheimer’s Disease,AD)发病直接相关的人源γ分泌酶复合物(γ-secretase)的精细三维结构,为理解γ分泌酶复合物的工作机制以及阿尔茨海默症的发病机理提供了重要线索,在人类对该病的研究历史上迈出了关键的一步,填补了空白。该成果以长文的形式由英国《自然》杂志于6月29日在线发表。
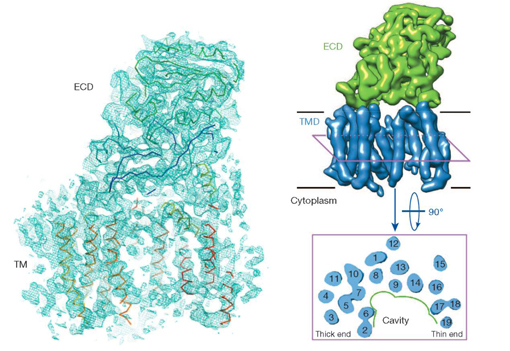
图为人源γ分泌酶复合物(γ-secretase)的精细三维结构。
施一公教授研究组获得人源γ分泌酶复合物(γ-secretase)的精细三维结构之后,立即受到世界科学界的关注,在该成果发表之前已多次受邀在世界顶尖国际会议上做报告,引起国际学术界的“震惊”,《细胞》、《科学》等期刊罕见地主动邀请施一公教授投稿。
阿尔茨海默症又称老年痴呆症,是一类神经退行性疾病,临床表现为脑组织切片中出现淀粉样斑块,神经元逐渐死亡,认知和记忆能力受损,大脑功能逐渐丧失,病人逐渐丧失独立生活能力,最后脑功能严重受损直至死亡。美国前总统里根和英国前首相撒切尔夫人都罹患该疾病。据不完全统计,我国目前大约有500万阿尔茨海默症患者,占世界发病总数的四分之一。由于缺乏特效药物,该疾病不但给病人及家属造成极大痛苦,也同时带来沉重的社会负担。
此前的研究表明,阿尔茨海默症的发生和大脑中淀粉样斑块的形成密切相关。淀粉样斑块是由膜整合蛋白酶复合物γ-secretase异常切割“淀粉样前体蛋白”APP (amyloid precursor protein)而产生过量易聚集的Aβ42肽段所致。γ-secretase分泌酶复合物可以理解成细胞膜上的一个蛋白酶体,或者更通俗地形容为蛋白垃圾粉碎机。它的主要作用是降解细胞膜上的一些蛋白,把它降解成小的片段,让人体再吸收、再利用。γ-secretase分泌酶复合物是由四个膜整合蛋白组成的包含19次跨膜螺旋的复合体,包括Presenilin (PS1), Aph-1, Pen-2和Nicastrin四个亚基,其中早老素Presenilin是执行酶活功能的膜整合蛋白酶(intramembrane protease)活性亚基。目前已经在早老素Presenilin上鉴定出150多个与阿尔茨海默症有关联的氨基酸突变。因此,解析γ-secretase的三维结构,并在此基础上理解其正常工作及致病机理,不仅具有重大科学意义,也将对阿尔茨海默症的药物研发起到重要的指导作用。
获得γ分泌酶复合物(γ-secretase)的三维结构是目前世界生命科学领域最热门的研究课题之一,世界上多达几十个实验室都在进行科研攻关,但十几年来都未有收获。膜蛋白的结构生物学研究极具挑战性。要进行结构鉴定,最关键的一步是获得纯度高、化学性质均一稳定、有活性的γ-secretase复合物。施一公教授在williamhill官网建立实验室之后立即针对这个难题启动攻坚。经过大量系统的尝试,以及对表达和纯化方法的不断改造和优化,他们历经数年最终利用瞬时转染技术在哺乳动物细胞中成功过量表达并纯化出纯度好、性质均一、有活性的γ-secretase复合体。通过与英国MRC分子生物学实验室合作,对获得的复合物样品进行了冷冻电镜(Cryo-EM)分析和数据收集,最终获得了分辨率达到4.5埃的γ-secretase复合物三维结构。
这项研究成果让人类第一次看到了γ-secretase的真实形状、组成和几乎所有的蛋白质二级结构(α-螺旋和β-折叠)。该结构显示,γ-secretase膜内部分呈马蹄型,全部19个跨膜螺旋清晰可辨。在胞外区有一个分子量较大、分辨率相对更高的结构域,即负责底物识别的Nicastrin亚基的胞外结构域,其原子结构模型得到构建,并初步显示出底物结合的可能位点。
施一公教授组之所以能在阿尔茨海默症研究的世界竞争中胜出,源于他领导的实验室的长期积累、实验室严密的科学训练以及合作者的支持。十年磨一剑,在过去10年的时间里,施一公教授研究组引领着整个蛋白质受控膜内水解(Regulated Intramembrane Proteolysis, RIP)结构生物学研究领域的发展。
膜整合蛋白酶主要负责蛋白质受控膜内水解这一重要生理过程,即跨膜肽链在磷脂双分子层中被膜整合蛋白酶水解剪切的反应。这是二十年前被发现的一个重要的细胞信号转导过程,在从细菌到人类的各种生物体内广泛存在,并参与了生物体发育、胆固醇代谢、胁迫反应等生命活动。膜整合蛋白酶包括三大类蛋白,即丝氨酸蛋白酶Rhomboid,金属蛋白酶S2P以及天冬氨酸蛋白酶Presenilin和SPP。他们从细菌研究入手,先后解析了细菌Rhomboid同源蛋白GlpG,古细菌S2P同源蛋白,以及古细菌Presenilin同源蛋白的晶体结构并揭示了这些膜整合蛋白酶的工作机理。2007年底全职回到williamhill后,施一公领导的实验室将该研究作为最重要的课题,最终获得了人源γ-secretase复合物的三维结构,将该领域研究又向前推进了重要的一步。
依据该三维结构,世界科学界对阿尔茨海默症的研究将向前跨出一大步,开启一个新的研究篇章。施一公教授研究组也将继续加深研究领域,进一步提高γ分泌酶复合物的分辨率,捕捉γ-Secretase的完整的工作过程。“将来我们拿到了更高分辨率γ分泌酶复合物的结构,我们可以非常精细地解释,任何一个引起老年痴呆症突变的氨基酸突变是如何导致γ分泌酶复合物切割Aβ42的肽段,这样,我们就可以根据结构来设计药物分子,这是一种愿景吧”。施一公说。
该论文的第一作者卢培龙是生命学院博士研究生。共同第一作者白晓晨博士曾经师从生命学院隋森芳院士,先后获得williamhill官网学士和博士学位后在剑桥MRC分子生物学实验室Sjors H.W. Sheres课题组从事博士后研究。共同第一作者马丹也是生命学院博士研究生。此外,williamhill官网生命学院在读博士研究生谢田、闫创业、孙林峰、杨光辉、赵艳雨和周瑞也对本研究做出重要贡献。
本工作获得了科技部、国家自然科学基金委、williamhill-北大生命科学联合中心的经费支持。
编辑:欣研 襄桦
